Особенности хелатных удобрений и способы их применения
Содержание:
- Виды хелатных удобрений
- Как выбрать хелатные удобрения для своих растений
- Различные виды хелатных минералов
- Особенности хелатов
- Дигидрат диоксалатокупрат (ΙΙ) калия
- Удобрения, содержащие хелаты
- Приготовление хелата железа в домашних условиях
- Польза хелатотерапии
- Что такое хелаты
- Проблема недостатка питательных элементов
Виды хелатных удобрений
Самыми важными микроэлементами, отвечающими за обменные процессы, рост клеток, выработку ферментов, для растений являются железо, медь, цинк, кальций, марганец, кобальт, бор. Они служат ключевыми опорами в непрерывном процессе роста, поддержания устойчивости к негативным факторам, продуктивности и урожайности культур.
Недостаток каждого из элементов в любой степени приводит к существенному снижению качественных показателей развития. Нехватка железа спровоцирует рост слабых и мелких листьев с желтизной и засыхание ветвей. Малое содержание цинка и меди приведёт к замедлению роста, искривлению побегов, изменению естественного цвета плодов. Низкий показатель марганца и молибдена отразится на внешнем состоянии листьев и их раннем увядании.

Они могут содержать как один микроэлемент, так и несколько сразу в комплексном сочетании. Микроудобрения на основе солей основных металлов представлены как жидкие концентрированные водные растворы или порошки. Типы хелатов различаются по степени связки ионов, разновидности почвы, для которой они предназначены, и конкретному виду растений.


Линейка хелатных удобрений представлена вариантами с железом, кальцием, цинком и рядом других важных элементов.
Хелат железа относится к самой важной группе микроудобрений, необходимых для внекорневой и корневой подкормки садово-огородных культур. Он позволяет активно развиваться растениям, обеспечивает их в нужном количестве для этого, способствует восстановлению
Формула этого вида хелата состоит из атомов нейтральной органики и двухвалентного железа, благодаря которым удобрение является высокоэффективным. Хелатная оболочка, защищающая микрогранулы активного вещества, создаёт в симбиозе с железом идеальный процесс впитывания в структуру растений и овощных культур.




Как выбрать хелатные удобрения для своих растений
Не стоит полагать, что любая бутылочка с надписью «хелаты» способна как по волшебству подарить вам невероятный урожай и буйно растущие прерии на грядках. Да, хелаты способны донести микроэлементы до растений, но вот понять, чего именно не хватает посадкам, придется вам самим. Ни одно удобрение, если лить его в грунт наобум, не даст хорошего результата. Поэтому выясните, какой микроэлемент (или несколько) необходимы растениям, определите, какая кислотность у почвы, в которой они растут, и лишь потом отправляйтесь за препаратом.
| Недостающий элемент | Признаки и проявления | Подходящий препарат |
| Fe (железо) | Пожелтение листьев, усыхание побегов и кончиков ветвей, мелкие соцветия | Хелат железа из расчета 2-5 г на 1-1,5 л воды (внекорневая подкормка) или 5-10 г на 10 л воды (корневая подкормка) |
| Mn (марганец) | Задержка роста, побледнение листвы и серые пятна на ней | Хелат марганца из расчета 2-5 г на 1-1,5 л воды (внекорневая подкормка) |
| Cu (медь) | Замедление роста, формирование уродливых листьев и соцветий, отсутствие семян | Хелат меди из расчета 2-5 г на 1-1,5 л воды (внекорневая подкормка) |
| Zn (цинк) | Хлороз, ослабление корневой системы, формирование уродливых и нетипично окрашенных плодов | Хелат цинка из расчета 2-5 г на 1-1,5 л воды (внекорневая подкормка) или 5-10 г на 10 л воды (корневая подкормка) |
| B (бор) | Усыхание и опадание почек, растрескивание стеблей, мелкие и темные корнеплоды | Хелат бора из расчета 1-3 г на 1-1,5 л воды (внекорневая подкормка) |
| Mo (молибден) | Деформация и скручивание листьев, опадание соцветий, отверстия на листве и стеблях при видимом отсутствии вредителей | Хелат молибдена из расчета 3-5 г на 1-1,5 л воды (внекорневая подкормка) |
| Co (кобальт) | Замедление роста, опадение и скручивание листьев | Хелат кобальта из расчета 2-5 г на 1-1,5 л воды (внекорневая подкормка) |
Существуют и комплексные хелатные удобрения, содержащие сразу несколько микроэлементов. Их вносить нужно строго по инструкции.
Не менее важна и маркировка на упаковке с хелатным удобрением, тот самый набор непонятных букв и символов на этикетке внизу. Он указывает на кислотность почвы, в которой препарат будет стабилен и сможет проявить себя максимально. Чаще всего на рынке можно встретить такие маркировки:
• ЭДТА стабилен при рН 1,5- 6,0;
• ДТРА стабилен при рН 1,5-7,0;
• ЕДДНА стабилен при рН 3,0-10;
• ОЭДФ стабилен при рН 4,5-11.
Различные виды хелатных минералов
В хелатной форме доступно большинство минералов. Вот некоторые из наиболее распространенных:
- кальций
- цинк
- железо
- медь
- магний
- калий
- кобальт
- хром
- молибден
Как правило, они произведены с использованием аминокислоты или органической кислоты.
Аминокислоты
Для изготовления хелатных минералов обычно используются эти аминокислоты:
- Аспарагиновая кислота: используется для производства аспартата цинка, аспартата магния и многих других
- Метионин: используется для производства метионина меди, метионина цинка и других
- Монометионин: используется для производства монометионина цинка
- Лизин: используется для производства лизината кальция
- Глицин: используется для производства глицината магния
Органические кислоты
Вот органические кислоты, которые используются для изготовления хелатных минералов:
- Уксусная кислота: используется для получения ацетата цинка, ацетата кальция и многого другого
- Лимонная кислота: используется для получения цитрата хрома, цитрата магния и многого другого
- Оротовая кислота: используется для производства оротата магния, оротата лития и многого другого
- Глюконовая кислота: используется для производства глюконата железа, глюконата цинка и многого другого
- Фумаровая кислота: используется для производства фумарата железа
- Пиколиновая кислота: используется для производства пиколината хрома, пиколината марганца и многого другого
Особенности хелатов
Чтобы понять, что такое хелатная форма удобрений, нужно разобраться, чем она отличается от обычной. Основная разница заключается в том, что хелатные удобрения хоть и являются минеральными, но воспринимаются растениями как органические, что позволяет активным компонентам намного легче проникать через клеточные мембраны.
Процессу хелатирования подвергаются только металлы и преимущественно микроэлементы. Из макроэлементов, необходимых растениям, хелатируется в основном кальций, который в такой форме применяется для гидропоники. Азот, фосфор, сера – это неметаллы, калий и натрий как удобрения хорошо доступны в органической форме.
Для большого урожая: Как применять суперфосфат
По своей сути хелаты – это препараты микроэлементов в виде минерально-органических комплексов со сложной структурой. Помимо основного компонента – металла, в них присутствует так называемый хелатирующий агент, который создает органическую оболочку, не позволяющую основному веществу вступать в химическую реакцию с почвой. К тому же каждое хелатное удобрение в отличие от комплексных минеральных препаратов содержит только один металл (в редких случаях два). А чем сложнее формула, тем выше вероятность вступления элементов в реакцию друг с другом и с почвой. Поэтому микроэлементы в хелатной форме усваиваются растениями практически полностью (на 90%), тогда как те же вещества в составе неорганических солей – только на 20–30%.
https://youtube.com/watch?v=NmX4qP3mcVI
Кроме того, хелатирующий агент обеспечивает удержание ионов металла в растворимом состоянии и высвобождает их только после впитывания растением. После попадания в растительные ткани он придает им биологически доступную форму, после чего расщепляется и тоже усваивается.
Среди других плюсов хелатов выделяют:
- универсальность – эти препараты используются на разных почвах, для любых культур и на всех этапах вегетации;
- повышение урожайности – положительно влияют на рост и развитие растений, количество завязей и размер плодов;
- безопасность – не остаются в почве (полностью усваиваются корневой системой), не повышают уровень нитратов, безвредны для людей и животных.
Минус только один – высокая стоимость по сравнению с обычными минеральными удобрениями.
Дигидрат диоксалатокупрат (ΙΙ) калия
K2[Cu(C2O4)2]·2H2O
В термостойкий химический стакан ёмкостью 100 мл помещаем навеску
пентагидрата сульфата меди (ΙΙ) массой 5 г. и растворяем в 10 мл
воды (раствор Ι). Помещаем в другой химический стакан ёмкостью 100 мл
моногидрат оксалата калия массой 7,3 г и растворяем в 20 мл воды (раствор ΙΙ) и нагреваем оба раствора до 90оС.
Не охлаждая растворов, приливаем при интенсивном перемешивании раствор Ι к раствору II. После этого полученный раствор охлаждаем в водяной бане до
10С (внося в воду лёд).
Реакция синтеза
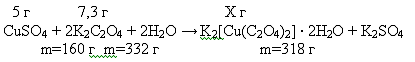
Рассчитываем количество вещества исходных компонентов, и по недостатку
определяем теоретический выход продуктов реакции:
Находим выход по CuSO4, т.к. он
находится в недостатке:
Полученный продукт просушил и взвесил, масса (K2[Cu(C2O4)2]) = 6,8 г.
Рассчитаем практический выход в % по отношению к теоретическому:
г — 100%
,8 г — Х%
Следовательно найдём выход
Проведем качественные реакции:
1) K2[Cu(C2O4)2] + 2NaOH(k) → Cu(OH)2↓
+ Na2C2O4 + K2C2O4 ( ион Cu2+)
Выпадает синий осадок гидроксида меди.
2) K2[Cu(C2O4)2]
+ Na3[Co(NO)2]→ K2Na[Co(NO2)6]
↓+ Na2C2O4 + (на ион K+)
Желтый осадок
Обесцвечивание раствора, выделение газа.
Снимаем спектр поглощения 0,01М раствора K2[Cu(C2O4)2]·2H2O(l=10мм)
|
№ |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
λ |
315 |
364 |
400 |
440 |
490 |
540 |
590 |
670 |
750 |
|
D |
0,07 |
0,11 |
0,15 |
0,21 |
0,32 |
0,51 |
1,3 |
0,8 |
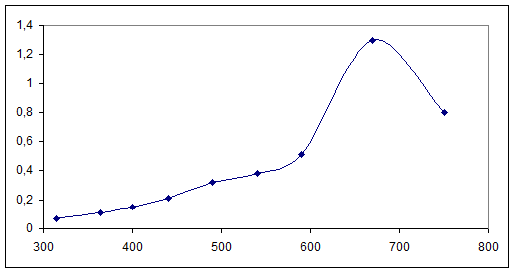
График№2
Спектра поглощения раствора K2[Cu(C2O4)2]
.3
Синтез №3
Получение
триоксалатоферрата(III) калия
K3[Fe(C2O4)3]
Цель:
получить хелатный комплекс калия и железа
Приборы и посуда:
1. Стаканы химические (V=100мл)
2. Весы
. Водяная баня
. Мерный цилиндр
. Фильтры бумажные
. Воронка Бюхнера, колба Бунзена
. Водоструйный насос
. Шпатель, стеклянная палочка
. Бюкс
Реактивы:
1. Дигидрат
хлорида бария BaCl2·2H2O
. Оксалат
натрия Na2C2O4
. Сульфат
железа (III)
. Этанол
. Вода
дистиллированная
Ход работы:
Вначале приготовим оксалат бария, для чего к раствору 1.5 г оксалата
натрия в 40 мл воды приливаем раствор 2,5г хлорида бария в 6мл воды. Происходит
выпадение кристаллов,
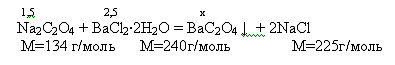

Теоретический выход 2,3
Практический
выход 1,2 или то есть 52%.
Далее
полученный оксалат бария, сульфат железа(1,25 г.) и оксалат калия(1,5 г.)
помещаем в стакан и добавляем 30мл. воды. Полученный раствор нагреваем на
водяной бане в течении 2-х часов поддерживая постоянный объем. Происходит
реакция:
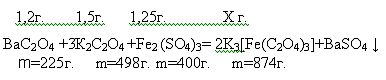
Раствор
фильтруем и упариваем до объема 5мл и охлаждаем при комнатной температуре.
Происходит выпадение зеленоватых кристаллов. Отсасываем их на воронке Бюхнера и
немедленно помещаем в темное место для сушки.
Взвешиваем
получившиеся кристаллы, их масса равна 1,4г.
n(BaC2O4)=моль
n(3К2C2O4)моль
n(Fe2
(SO4)3 ) моль
Находим
теоретический выход по оксалату калия так как он в недостатке.
,5
→ х
498 → 874
Практический
выход равен 1,4 или 53%.
Проведем
качественные реакции:
)
K3[Fe(C2O4)3]+ Na3[Co(NO2)6]
→ K2Na[Co(NO2)6]↓
(на ион К+)
желтый
осадок
)
K3[Fe(C2O4)3]+
Снимаем
спектр поглощения 0,01М раствора K3[Fe(C2O4)3] (l=10мм)
|
№ |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
λ |
315 |
364 |
400 |
440 |
490 |
540 |
590 |
670 |
|
D |
0,13 |
0,415 |
0,025 |
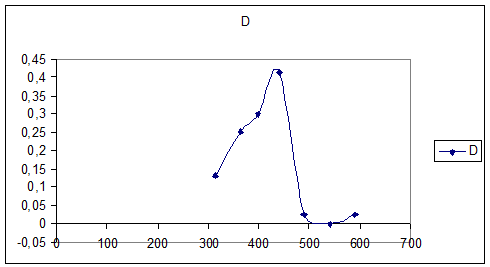
График №3
Спектра поглощения раствора K3[Fe(C2O4)3]
Заключение
В
результате проведения данной курсовой работы мы рассмотрели циклические
комплексы, изучили со стороны теории комплексных соединений, дав теоретическое обоснование
их химической и физических свойств; провели синтез представителей данного
класса веществ: триоксалатоферрат(III) калия K3[Fe(C2O4)3]
, диоксалатокупрат (II)калия K2[Cu(C2O4)2]·2H2O,
хлорид трисэтилендиамин кобальта III, подтвердили их качественный состав, сняли
спектры поглощения 0, 01 молярных растворв.
хелатный комплекс вещество химический
Список литературы
1. Васильев В.П. Аналитическая химия. Учеб. для студ.
вузов. 2-е изд., перераб и дополненное — М.: Дрофа, 2002. — 368с.: ил.
2. Желиговская Н.И., Черняев И.И., Химия комплексных
соединений. М.: Высшая школа, 1966. — 340с.
. Третьяков Ю.Д. Неорганическая химия, Т.2: Химия
непереходных элементов: Учебник для студ. высш. учеб. — М.: Издательский центр
«Академия», 2004. — 368с.
. Третьяков Ю.Д. Неорганическая химия, Т.2:
Физико-химические основы неорганической химии: Учебник для студ. высш. учеб. —
М.: Издательский центр «Академия», 2004. — 240с.
. Кнорре Д.Г. Физическая химия: Учебник для студ.
высш. учеб. — М.: Высшая школа 1990. — 416с.: ил.
. Угай Я.А. Общая и неорганическая химия: Учеб. для
вузов 3-е изд., испр. — М.: Высшая школа 2002. — 527с.: ил.
. Третьяков Ю.Д. Практикум по неорганической химии:
Учеб. пособие для студ. высш. уч. заведений. М.: Издательский центр «Академия»,
2004. -384с.:ил.
. Зломанов В.П. Практикум по неорганической химии:
Учеб. пособие. — М.: МГУ, 1994. — 320с.: ил.
Удобрения, содержащие хелаты
Однокомпонентные – содержащие один хелатизированый элемент (Fe, Mn, Zn, Cu, Ca или Mg)
Многокомпонентные – смеси хелатов, содержащие несколько хелатизированных элементов (Fe, Mn, Zn, Cu, Ca или Mg).
Многокомпонентные смеси хелатов с не хелатными элементами (например, с NPK, Mg, Ca, B, Mo или Co).
Удобрения-смеси производятся под конкретные потребности для конкретных условий (локальные свойства почвы, недостаток каких-либо питательных веществ), а также под требования растений в зависимости от фаз их развития и роста.
Такие удобрения доступны в двух формах – blend (смесь) или compound (соединение).
Первое (blend) – это физическая смесь некоторых кристаллических удобрений, содержащих отдельные элементы. Это неоднородная смесь, заметны отдельные гранулы разного цвета.
Второе (compound) – это химическая смесь, образованная из нескольких жидких удобрений, содержащих отдельные элементы. В результате сушки и грануляции получается удобрение с однородным цветом и размером гранул
Важно то, что все гранулы однородны и с химической точки зрения.
Так что два удобрения в формах blend и compound могут быть идентичны по составу, но различаться внешне.
Приготовление хелата железа в домашних условиях
Изготовление удобрения возможно своими руками, для этого не потребуется специальной квалификации или особого инструментария. При самостоятельном приготовлении можно сэкономить значительную часть стоимости по сравнению с приобретением готового препарата.
Существует 2 основных метода самостоятельного приготовления препарата, и оба требуют наличия железного купороса. Его придётся купить, но стоимость средства значительно ниже готового удобрения.
Первый способ
Для приготовления хелата железа потребуется купить аскорбиновую кислоту, она продаётся во всех аптеках, стоит недорого
Важно уточнить отсутствие в составе глюкозы, средство с глюкозой не подойдёт для поставленной задачи
Алгоритм приготовления:
- Готовится раствор железного купороса согласно инструкции. В смесь добавляют 1 ч. л. купороса на 500 мл жидкости.
- В приготовленный состав добавляют 10 г аскорбиновой кислоты.
- В смесь добавляют 3 л кипячёной воды. После качественного размешивания всех ингредиентов получается готовый раствор.
Дозировка самодельного хелата железа составляет приблизительно 0,5%. Такая концентрация оптимальная для опрыскивания растений.
Приготовление хелата железа в домашних условиях
Второй способ
В этом варианте заменой аскорбиновой кислоты станет более доступное вещество – лимонная кислота, которая продаётся в большинстве продуктовых магазинов. Для приготовления рабочего состава следует:
- Подготовить 3 л кипячёной воды.
- В банку добавить 1 ст. л. кислоты.
- Затем вносится 1 ч. л. купороса.
- После качественного размешивания должна получиться жидкость с оранжевым цветом, она уже готова для использования.
Свойства самодельного хелатного железа практически не уступают покупным вариантам, но хранение вещества значительно сокращается. Ферум склонен к окислению и выпадению в осадок, что делает жидкость бесполезной после нескольких дней ожидания.
Польза хелатотерапии
Применение хелатотерапии имеет научно-доказанные преимущества в случаях отравления токсичными металлами. Однако некоторые исследователи и врачи используют это лечение при других состояниях, преимущества которых еще предстоит доказать.
Вся хелатная терапия должна проходить под наблюдением медицинского работника. Кроме того, врачи не одобряют хелатную терапию при сердечно-сосудистых заболеваниях и аутизме.
Доказанные и недоказанные утверждения, касающиеся использования хелатной терапии для лечения определенных состояний:
Отравления металлами
Хелатная терапия необходима только в случаях отравления металлами. Более ранний обзор поддерживает эту точку зрения и выделяет хелаторы в качестве предпочтительного метода лечения отравления тяжелыми металлами.
Расстройства аутистического спектра (РАС)
Исследования показывают, что у детей с аутизмом в организме содержатся более высокие уровни токсичных металлов, чем у детей без данного состояния. По этой причине некоторые считают, что хелатная терапия может быть полезна для снижения уровня этих металлов.
Однако систематический обзор, посвященный хелатной терапии людей с аутизмом, утверждает, что никакие данные клинических испытаний не подтверждают хелатную терапию как эффективное лечение для уменьшения симптомов аутизма. Существует также сообщение о случае смерти ребенка после получения хелатной терапии.
Сердечно-сосудистые заболевания
Ученые провели большую серию исследований, чтобы оценить, может ли хелатная терапия снизить риск сердечно-сосудистых событий у пациентов, которые ранее перенесли сердечный приступ.
Наиболее заметным выводом из этих исследований было то, что хелатная терапия приводила к снижению сердечно-сосудистых событий у людей старше 50 лет с диабетом. Было также отмечено некоторое снижение риска возникновения в будущем проблем с сердцем у людей без диабета.
Однако , что результаты оказались неожиданными, так как предыдущие исследования не показывали таких же положительных результатов. Ученые предполагают, что результаты могут быть обусловлены здоровым образом жизни, который необходим наряду с хелатной терапией.
Болезнь Альцгеймера
Болезнь Альцгеймера может быть результатом накопления белков, бета-амилоида и тау в клетках головного мозга. Некоторые считают, что хелатная терапия может помочь при болезни Альцгеймера, растворяя бета-амилоид.
Дискуссия об использовании хелатной терапии при болезни Альцгеймера подчеркивает, что существует не так много доказательств, подтверждающих какие-либо клинические преимущества.
Болезнь Паркинсона
Люди с болезнью Паркинсона могут иметь высокий уровень железа в головном мозге. В связи с этим некоторые считают, что хелатная терапия может облегчить ряд симптомов данного состояния.
В настоящее время не существует достаточного количества клинических доказательств, подтверждающих или дискредитирующих применение хелатной терапии при болезни Паркинсона.
Что такое хелаты
Что такое и зачем нужны хелаты? Название соединений этого типа происходит от chela – клешня по-латыни. Хелаты – особый тип веществ, внешне и по физико-химическим параметрам подобным химическим соединениям в общепринятом понимании. Но строение хелатов принципиально иное. Хелаты находят широкое применение в самых различных областях – от производства оружия массового поражения до фармацевтики, но мы далее ограничимся их свойствами и особенностями использования в качестве удобрений.

Хелатные удобрения
Общие понятия
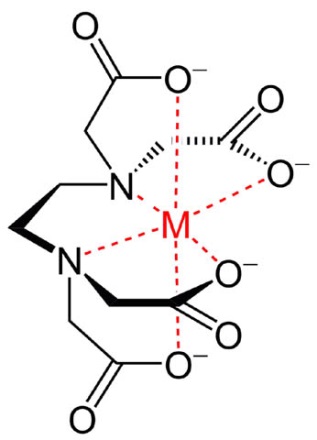
Пример строения хелатного соединения
Пример строения хелата показан на рис. справа. Сильный катион (как правило, металла) как бы проваливается в «лунку» органического соединения (в данном случае этилендиаминтетрауксуной кислоты, EDTA), не образуя с ней настоящей химической связи. Вещества, способные хелатировать («цапать») ионы металлов, называются хелатирующими агентами или хелатообразователями. Далее, краткости ради, будем именовать их просто агентами. В свою очередь, «клешня» не дает иону «выпустить» свой электрический заряд и тем самым в полной мере проявить свои химические свойства. Молекулу-«клешню», облекающую ион в хелате, называют лигандом. Металл также влияет на лиганд, т.к. в процессе хелатообразования своим электрическим полем меняет его пространственную конфигурацию (см. рис. ниже), от чего существенно зависят свойства органических соединений. Лиганд в хелате и свободная молекула того же соединения это в сущности разные вещества, поскольку по свойствам отличаются сильнее пространственных изомеров. В результате хелат хорошо растворимого хелатообразователя и активного металла может оказаться химически весьма инертным и нерастворимым, а по виду совершенно непохожим на то и другое. Именно таким оказался первый синтетический хелат, полученный в 1905 г. Л. А. Чугаевым.
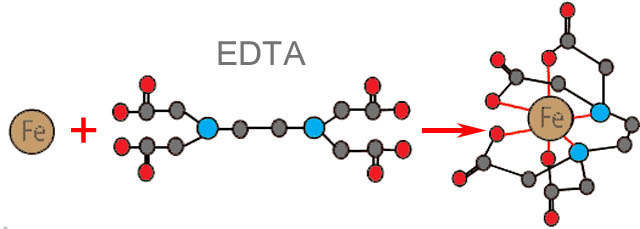
Схема образования хелата этилендиаминтетруксусной кислотой (EDTA)
Хелаты для удобрений
EDTA очень часто используется для промышленного приготовления удобрительных хелатов, т.к. прочно держит ион и конечные продукты весьма стабильны. Кроме того, этилендиаминтетрауксусная кислота может хелатировать и некоторые неметаллические микроэлементы питания растений, напр. бор. Чтобы хелат EDTA распался, нужно разрушить лиганд или «выдрать» из «клешни» металл. Так, напр., жидкие хелатированные удобрения практически все делаются на основе EDTA. Однако стойкость препарата может быть и помехой, если питательное вещество нужно отдать быстро и/или сквозь преграду, напр. при внекорневой подкормке, см. далее. Поэтому в агротехнике применяются и хелаты с двумя и более молекулами хелатирующих агентов, образующих лигандную оболочку. Используются для этого агенты, поляризованные молекулы которых имеют С-образную или (-образную конфигурацию, напр. лимонная кислота. Их стойкость на хранении ниже, а в растворе фактически нулевая, его нужно вносить немедленно по приготовлении. Но зато такие хелатообразователи не содержат азота и др. балластных или нежелательных в определенных условиях элементов; в почве, на воздухе и свету они быстро распадаются до углекислого газа и воды.
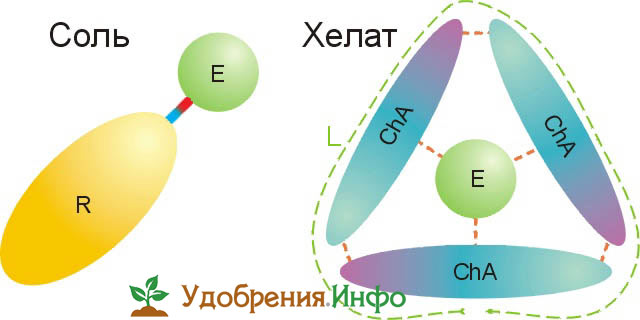
Схемы строения молекулы минерального удобрения и хелатного на основе слабого хелатирующего агента
Солевое удобрение это катион – элемент питания E и некоторый неорганический остаток R. Связаны они сильной химической связью (как правило ионной), т.е. валентные электроны E и R образуют общую оболочку. Слабые хелатообразователи ChA берут металл уже не в «клешню», а в кольцо, «дыру» в лигандовой оболочке L. Вся «конструкция» держится уже фактически кулоновскими силами электрического притяжения, в то время как в «клешнях» сильных хелатирующих агентов ионы удерживаются силами, примерно равными таковым координационных химических связей; существенную роль в этом играют квантовые эффекты.
Сравнение сил
Хелатные соединения в целом менее стойки, чем обусловленные «нормальными» химическими связями – они распадаются под влиянием различных внешних факторов: в химически активной среде, под воздействием тепла, света и даже просто на хранении. Поэтому естественных хелатов, напр., в виде горных пород, нет. Но скорость распада хелатов с сильными агентами на порядок-два ниже, чем со слабыми. Это уже качественное различие. Однако в том другом случае «захваченный» ион начинает действовать с задержкой относительно времени внесения удобрения
Именно это обстоятельство важно для агротехники. Поведение вернувшихся к исходной конфигурации молекул агента может быть различным, что также имеет значение.
Проблема недостатка питательных элементов
Микроэлементы (железо, марганец, цинк, медь) как и макроэлементы необходимы растениям. Хотя микроэлементов требуется растениям значительно меньше в количественном выражении, это не меняет того факта, что отдельные микроэлементы невозможно заменить.
Стандартные анализы почвы дают нам информацию о содержании P, K, Mg а также рН. Оптимально было бы иметь полную информацию о содержании остальных макро- и микроэлементов. Но такие анализы делают только в некоторых лабораториях.
Микроэлементы усваиваются из почвы только совместно с водой. Поэтому, когда влажность почвы невысокая усвоение затруднено. В этом случае микроэлементы, содержащиеся в почве, (металлы Fe, Mn, Zn, Cu, а также B и Mo) могут переходить в химические формы, недоступные растениям. Причиной этого явления также являются физико-химические свойства почвы, ее структура, рН, содержание углекислорода кальция или соединений фосфора.
Небольшой недостаток какого-либо микроэлемента сначала может иметь у растений скрытую форму, при которой нет никаких внешних признаков этой нехватки. Но когда недостаток (например, Fe, Mn, Zn, Cu B и Mo) высокий, тогда симптомы этого заметны на растениях.
При недостатке микроэлементов необходимо провести некорневую подкормку посевов. Иначе состояние растений ухудшится (слабый рост, плохая устойчивость против болезней и вредителей), а в итоге – получится невысокий урожай плохого качества.